

|
|
 |
 |
|
|
|
Систематическое положение (Kingdom, Phylum, Class, Order, Family, Species): Царство — животные, Animalia. Тип — моллюски, Mollusca. Класс — двустворчатые, Bivalvia. Отряд — Veneroida. Семейство — мактры, Mactridae. Вид — атлантическая рангия, Rangia cuneata.  Rangia cuneata - Атлантическая рангия . Фото А.А. Гусева, Вислинский залив Русское и английское названия. Атлантическая рангия Atlantic rangia Синонимы. Клиновидный моллюск (wedge clam, gulf wedge clam), обычная рангия (Сommon rangia), американская пляжная ракушка (Amerikaanse strandschelp), Gnathodon cuneata G.B. Sowerby I, 1832; Gnathodon cuneata nasutus Dall, 1884; Gnathodon nasutus Dall, 1884; Rangia cyrenoides Des Moulins, 1832; Rangianella cuneata Conrad, 1868. Нативный ареал. Мексиканский залив. В естественном ареале встречается с юга Мексиканского залива от лагуны Де Терминос (залив Кампече, штат Кампече, Мексика) и вдоль всего побережья залива на север до штата Флорида (США) (Verween et al., 2006). Современный ареал (мировой и конкретнее в России). Обитает в устьях рек, заливах и лагунах Мексики и США вдоль Атлантического побережья Северной Америки от Мексиканского залива до реки Гудзон. У берегов Европы моллюски обнаружены в бассейнах Северного (Бельгия, Нидерланды, Германия и Англия) и Балтийского морей (Германия, Польша, Литва, Эстония, Россия – Калининградская область). По зоогеографической принадлежности вид можно отнести к бореально-субтропической группе. Дальнейшее распространение рангии возможно вдоль северо-восточного побережья Евразии на юг: пролив Ла-Манш, Бискайский залив, бассейны Средиземного, Черного и Азовского морей. В восточном полушарии обнаружен на западе Африки (Marelli, Gray, 1983). В Европе впервые зарегистрирован в Бельгии (Antwerp Harbor) в 1835 г., расселился в Нидерландах, Франции, Великобритании, Испании, Германии (Forsström et al., 2016). С 1996 по 2015 г. найден в Понто-Каспийском регионе: 5 находок в Черном море и Таганрогском заливе Азовского моря, 3 - в Каспийском море (Zhulidov et al., 2018). В начале XXI в. отмечен в Балтийском море (Финский, Ботнический и Гданьский заливы - прибрежные воды Финляндии, Швеции, России и Польши) (Орлова и др., 2015; Fosström et al., 2016). В российской части приобретенного ареала зарегистрирован на 3 эстуарных и прибрежных участках Понто-Каспийского региона: в дельте Волги вблизи Астраханского биосферного заповедника (Прикаспий), в Таганрогском заливе (Азовское море) и в бухте р. Туапсе (Черное море) (Zhulidov et al., 2018). В российском секторе Балтийского моря найден в 2014 г., но, судя по размерно-возрастному составу особей, натурализовался здесь до середины 2000-х гг. Популяция пока остается строго в границах прибрежной зоны Копорской Губы Финского залива, отепленной из-за работы Ленинградской атомной станции (Орлова и др., 2015). 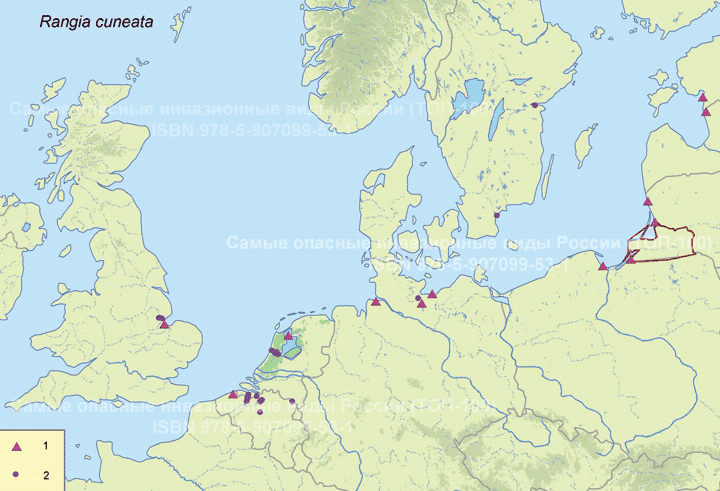 Инвазионная часть ареала R. cuneata в Европе Места находок; 1 – по литературным источникам (см. в тексте), 2 – по GBIF (Occurrence Download https://doi.org/10.15468/dl.ijnrey). Зеленый цвет – первичный очаг инвазии в Европу © Проект РНФ, № 16-14-10323 (Рук. В.Г. Петросян), ИПЭЭ РАН Пути(коридоры) и векторы (способы) интродукции. До 1956 г. двустворчатый моллюск Rangia cuneata был известен только из Мексиканского залива. Вид считался вымершим в плейстоцене у Атлантического побережья Северной Америки и северной части Южной Америки. В 1960-1961 гг. атлантическая рангия была впервые найдена на восточном побережье Северной Америки (река Потомак, Чесапикский залив, США), затем в 1960-х гг. вид быстро распространился в устьях многих рек и прибрежных эстуариях от штата Нью-Джерси до штата Флорида. В 1970-х гг. рангия начала проникать в акватории к северу от штата Нью-Джерси, и в настоящее время самой северной точкой обитания R. cuneata в северо-западной части Атлантического океана считается река Гудзон (штат Нью-Йорк, США), где она была впервые обнаружена в 1988 г. Предполагается, что повторное расселение рангии вдоль восточного побережья Северной Америки могло произойти тремя способами: во-первых, моллюски могли быть завезены вместе с американской устрицей Crassostrea virginica (Gmelin, 1791) из Мексиканского залива при работах по её расселению. Во-вторых, их личинки могли быть перенесены балластными водами судов; в-третьих, они могли быть случайно транспортированы с дноуглубительной техникой, которая до этого работала в Мексиканском заливе (экскаватор, баржа или дноуглубительное судно). Впервые у берегов Европы R. cuneata была обнаружена в каналах порта г. Антверпен (Бельгия) в августе 2005 г., и ее проникновение связано с балластными водами судов, пришедших с Североамериканского континента (обзор: Verween et al., 2006). Однако предполагается, что рангия проникла сюда раньше, примерно в 2000 г. (Kerckhof et al., 2007). В июне 2008 г. моллюски были зарегистрированы в Нордзе-канале у г. Амстердам (Нидерланды) (Melchers, Moolenbeek, 2008). В сентябре 2010 г. атлантическая рангия была обнаружена в российской части Вислинского залива (Россия). Проникновение моллюска в Вислинский залив может быть связано как с балластными водами, так и с дноуглубительными судами под флагом Нидерландов, начавшими работать в акватории Калининградского морского канала в 2008 г. (Рудинская, Гусев, 2012). Посредством течений планктонные личинки моллюска проникли в польскую часть Вислинского залива в 2011 г. (Warzocha et al., 2016). В 2013 г. вид обнаружен в Литве в солоноватоводной части Куршского залива (Solovjeva, 2014). С 2013 г. в прибрежной зоне Балтийского моря на участке от г. Зеленоградск до пос. Морское регулярно отмечается молодь атлантической рангии (длиной менее 5 мм) на глубинах менее 10 м (Гусев, персональное сообщение). В 2014 г. R. cuneata впервые зарегистрирована в р. Смяла-Висла, которая расположена юго-западнее Вислинского залива (Janus et al., 2014). В Германии в акватории Северного моря рангия была обнаружена в 2013 г. в Кильском канале у г. Брунсбюттеле (Bock et al., 2015), в бассейне Балтийского моря – в 2015 г. у г. Любек, в «Великой лагуне» природного заповедника Шелбрух (Wiese et al., 2016). В 2015 г. рангия была найдена в двух искусственных каналах впадающих в р. Уитем недалеко от г. Бостон графства Линкольншир, Великобритания (Willing, 2015). В 2014 г. в Пярнуском заливе (Эстония) сначала были обнаружены створки мертвых особей атлантической рангии и только в октябре 2016 г. пойманы живые моллюски (Möller, Kotta, 2017). Активизация судоходства способствует активному распространению R. cuneata. Вероятно, с балластными водами судов личинки атлантической рангии могут преодолевать большие расстояния и расселяться в различных морях и океанах. Также взрослые моллюски могут быть перевезены из одного моря в другое дноуглубительными судами. В переделах одного водоема (моря, залива) моллюски активно расселяются посредством планктонных личинок, которые переносятся течениями на значительные расстояния. Они могут быть завезены случайно при интродукции других видов: так рангия расселилась, попав в садки с американской устрицей – Crassostrea virginica, которую вначале 1960-х гг. из Мексиканского залива намеренно переселяли в Чесапикский залив. Местообитание. Наиболее благоприятные условия для R. cuneata – сочетание низкой солености, высокой мутности и мягкого субстрата из песка, ила и растительности. Моллюски обычно живут при солености 0–18‰. Наибольшая численность и число размерных классов моллюсков наблюдаются при низкой солености 0–2‰. R. cuneata обладает как внеклеточными, так и внутриклеточными механизмами осморегуляции, что позволяет ей реагировать на внезапные изменения солености в эстуарных экосистемах. Низкая температура воды зимой отрицательно влияет на выживание моллюсков. Особи данного вида малоподвижны, но способны к вертикальному перемещению в толще грунта. Моллюски способны переносить условия дефицита кислорода, но крайне плохо переносят осушение. Взрослые особи предпочитают мягкие субстраты на глубинах менее 6 м. По типу питания моллюски относится к безвыборочным фильтраторам. Они потребляют большое количество детрита и фитопланктона (Рудинская, Гусев, 2012; Гусев, Рудинская, 2013). Некоторые особенности биологии. R. cuneata – раздельнополые моллюски, соотношение полов обычно 1:1, но бывает, что самки преобладают. У рангии отмечены также гермафродитные особи. Моллюск достигает длины 6–94 мм и обладает высокой скоростью роста, достигающей 15–20 мм в первый год жизни. Максимальный возраст составляет 6–12 лет. Созревают при длине раковины 14–24 мм на второй год жизни. Размножаются два раза в год в феврале–июне и августе–ноябре. При благоприятных условиях размножение может продолжаться в течение всего теплого периода года. Гаметогенез начинается, когда температура воды достигает 15 °С и выше, а соленость находится в диапазоне от 0‰ до 15‰. Планктонные стадии более уязвимы к солености и в пресноводных условиях не развиваются. Оптимальные условия для развития – температура 18–29 °C и соленость 6–10‰. Осевшая молодь способна жить при температуре 8–32 °С и солености воды 2–20‰. Выживание осевшей молоди снижается при следующих сочетаниях этих двух факторов: низкой солености и высокой температуре или высокой солености и низкой температуре. Педивелигеры предпочитают твердые субстраты, но это не является необходимым условием для оседания и метаморфоза (Рудинская, Гусев, 2012). Средний диаметр яйца Rangia cuneata перед оплодотворением составляет около 56–69 µм. В лабораторных условиях при температуре воды от 23–27 °С и солености 8–10‰, первые сферические реснитчатые бластулы, у которых отмечаются признаки движения, появляются через 8–9 часов после оплодотворения (57–86 µм) (Fairbanks, 1963; Sundberg, Kennedy, 1992). Первые трохофоры формируются через 12 часов (67–86 µм), а первые D-образные велигеры – через 16 часов после оплодотворения и имеют размеры от 73 до 130 µм (Chanley, 1965; Sundberg, Kennedy, 1992). В стадию великонха моллюски переходят при длине – от 115 до 175 µм на 4–5 сутки. Функциональная нога развивается, когда длина великонха составляет 160 µм и более. Педивелигеры имеют размер от 160 до 203 µм и формируются через 6–7 дней после оплодотворения. Метаморфоз педивелигеров начинается на седьмые сутки после оплодотворения. Наименьшие размеры моллюсков без велума (паруса) были 170 µм. Жабры появлялись у моллюсков прошедших метаморфоз при длине 175–180 µм (Chanley, 1965; Sundberg, Kennedy, 1992). Осевшая молодь имеет размеры от 180 до 500 µм (Chanley, 1965; Fairbanks, 1963; Sundberg, Kennedy, 1992 и др.). Полностью сформированные ювенильные особи атлантической ранги с функционирующим сифоном отмечаются через 50 дней после оплодотворения или 42 дня после оседания. Их средняя длина составляет 1,35 мм (Sundberg, Kennedy, 1992). По-видимому, фаза планктонного существования может длиться от одной недели при оптимальных условиях, а при отсутствии таковых до нескольких месяцев. Влияние вида (на другие виды, экосистемы включая лесную и агроценозы, здоровье человека). Атлантическая рангия оказывает негативное влияние на экосистему, в которую она проникла, так как она быстро занимает доминирующее положение, тем самым приводит к изменениям структурно-функциональных характеристик экосистемы в короткие сроки. В Вислинском заливе в годы максимального развития R. cuneata наблюдается снижение количественных характеристик хирономид, полихеты Hediste diversicolor (O.F. Möller, 1776) и двустворчатых моллюсков (конкурируют за пищу с Limecola balthica (Linnaeus, 1758) и Mya arenaria Linnaeus, 1758, возможно и с другими видами), и увеличение – инвазионной полихеты Marenzelleria neglecta Sikorski and Bick, 2004 и олигохет, что отрицательно сказывается на кормовой базе рыб-бентофагов. Обнаружено резкое уменьшение численности и биомассы рачкового зоопланктона (Науменко и др., 2014). После появления в Вислинском заливе R cuneata доля коловраток в биомассе значительно возросла, а ветвистоусых и веслоногих ракообразных – снизилась, что отрицательно сказалось на кормовой базе рыб-планктофагов (Науменко и др., 2014; Semenova, Dmitrieva, 2013). Планктонные личинки атлантической рангии, вероятно, вступают в конкурентные отношения за пищевой ресурс с аборигенными видами зоопланктона. Отмечено, что R. cuneata избирательно выедает более ценные в энергетическом отношении зеленые и диатомовые водоросли, в результате чего цианобактерии получают конкурентное преимущество для своего развития (Semenova, Dmitrieva, 2013). Моллюски значительно влияют на самоочищение и увеличение прозрачности воды (Gusev et al., 2014). С появлением моллюсков снизилась концентрация хлорофилла «а» в 2 раза (в отдельные годы до 4 раз) и трофический статус водоема изменился с гипертрофного на эвтрофный (Александров и др., 2015). Атлантическая рангия, как и другие активные фильтраторы, способствует перемещению пула углерода из планктонного в бентосное сообщество. Установлено, что раковины моллюсков являются субстратом для прикрепления других инвазионных видов Dreissena polymorpha (Pallas, 1771) и Amphibalanus improvisus (Darwin, 1854), экономический ущерб от которых известен. Этот факт значительно расширяет площадь, занимаемую другими интродуцентами в Вислинском заливе (Warzocha et al., 2016; Гусев, персональное сообщение). R. cuneata является важным пищевым объектом эстуарных экосистем для рыб, крабов, брюхоногих моллюсков, водоплавающих птиц и гребневиков. Существует угроза при натурализации атлантической рангии в водоемах-реципиентах привнесения новых паразитов с непредсказуемыми последствиями для аборигенных видов (Рудинская, Гусев, 2012; Kornijów et al., 2018). Впервые закупорка трубопроводов пожарных гидрантов атлантической рангией была зарегистрирована на нефтеперерабатывающем заводе в г. Делавэр (Counts, 1980). С февраля 2006 г. R. cuneata часто стали встречать в трубопроводах систем охлаждения промышленных предприятий г. Антверпен. Таким образом, этот вид следует считать опасным, засоряющим водозаборные трубопроводы и наносящим экономический ущерб. Наличие слоя мягкого грунта - это обязательное условие для начала засорения водозаборных трубопроводов промышленных систем водяного охлаждения. Атлантическая рангия оседает на слой мягкого субстрата, который имеется в трубах. В процессе жизнедеятельности и роста моллюсков происходит увеличение площади мягкого субстрата, что создает условия для повышения плотности поселения рангии. Это приводит к уменьшению сечения трубопроводов и увеличению гидродинамического давления, что может привести к неисправности систем охлаждения и пожаротушения предприятий (Verween et al., 2006). Контроль численности. Необходимо организовать мониторинг распространения R. cuneata в бореальной зоне Атлантического океана. В качестве мер сдерживания распространения атлантической рангии в другие бассейны необходимо вести контроль и обезвреживание балластных вод в портах, а также сбрасывать балластные воды в открытой части океана. Для борьбы с личинками возможно применение ультразвука. Основное условие для ограничения попадания моллюсков в трубопроводы систем забора воды – это отсутствие в них слоя мягкого грунта, что может быть достигнуто изменением тока воды в обратном направлении под высоким давлением. Для удаления взрослых особей и мертвых раковин из трубопроводов целесообразно применять механические способы борьбы. Добытые таким образом раковины R. cuneata можно использовать для производства дорожно-строительных материалов, химикатов, сельскохозяйственной извести, а также в качестве источника карбоната кальция и добавок в корм для птицы и скота (Рудинская, Гусев, 2012). Согласно данным USACE (1987) в 1980-х гг. ежегодный доход от добычи раковин атлантической рангии в озерах Пончартрейн и Морепас составил около 34 млн. долларов США. Применение моллюскоцидов не целесообразно, так как они уничтожат не только атлантическую рангию, но и местные виды двустворчатых моллюсков. Для борьбы с этим видом можно применять дренирование на небольших каналах или путем временного осушения трубопроводов. Авторы. Гусев А.А., Фенева И.Ю.
Литература.
| ||||||||||||||||||||||||||||||||||||||||